 |
 |
- Search
| Neonatal Med > Volume 30(2); 2023 > Article |
|
Abstract
Purpose
Methods
Results
ARTICLE INFORMATION
Ethical statement
This study was approved by the Institutional Review Board of Asan Medical Center (IRB S2022-1357-0002). Written informed consent by the patients was waived due to a retrospective nature of our study.
Figure 1.
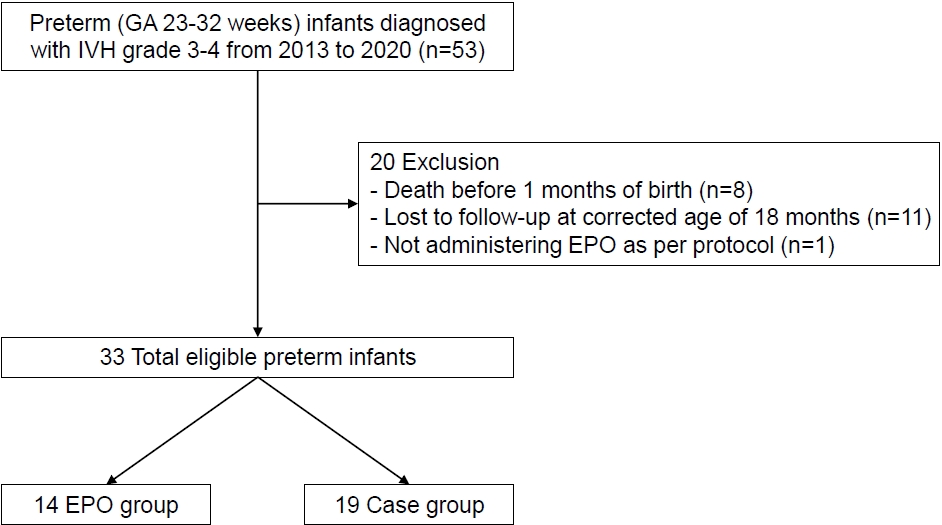
Table 1.
Table 2.
Values are expressed as number (%) or median (interquartile range).
Abbreviations: EPO, erythropoietin; BPD, bronchopulmonary dysplasia; NEC, necrotizing enterocolitis; SIP, spontaneous intestinal perforation; PN, parenteral nutrition; PDA, patent ductus arteriosus; ROP, retinopathy of prematurity; LIO, laser indirect ophthalmoscope; PVL, periventricular leukomalacia.
Table 3.
Table 4.
Values are expressed as number (%), mean±standard deviation, or median (interquartile range).
Abbreviations: EPO, erythropoietin; NDI, neurodevelopmental impairment; ROP, retinopathy of prematurity; LIO, laser indirect ophthalmoscope; BPD, bronchopulmonary dysplasia; RBC, red blood cell; t/f, transfusion.
Table 5.
REFERENCES
-
METRICS

-
- 0 Crossref
- 1,589 View
- 39 Download
- Related articles in NM
-
Effect of Indomethacin Therpy on Prevention of Intraventricular Hemorrhage in Very.1998 June;5(1)






