A Rare Case of Oligodendroglioma in Sacrococcygeal Mature Teratoma Diagnosed in Preterm Infant
Article information
Abstract
Sacrococcygeal teratoma is the most common congenital tumor in neonates, and is reported in approximately 1/35,000 to 1/40,000 live births. Oligodendroglioma is a rare central nervous system tumor that is usually found in the cerebral hemisphere of young and middle aged adults. When associated with a teratoma, it is mainly identified in ovarian teratoma in adolescents and adults. We describe a rare case of a preterm infant with oligodendroglioma in a mature sacrococcygeal teratoma. The male neonate was born at a gestational age of 30 weeks with a protruding mass in the sacrococcygeal region. Pelvic magnetic resonance imaging showed a sacrococcygeal teratoma of approximately 11 cm comprising fat components and skeletal structure, that extended from the anterior part of the sacrum to the abdominal cavity. Radical resection was performed at 36 days of age. Macroscopically, the resected intra-abdominal mass had the characteristics of a cystic lesion, and the intrapelvic mass was a predominantly solid mixed cystic-solid lesion. Histologically, this solid lesion in the intrapelvic mass was composed of mature glial tissue, which comprised as a proliferation of monotonous cells with small and round nuclei, surrounded by a perinuclear halo (“fried egg” appearance). Additionally, these cells were immunohistochemically positive for glial fibrillary acidic protein. These findings confirmed the diagnosis of oligodendroglioma in sacrococcygeal mature teratoma. After the treatment, no recurrence was observed during the follow-up period, and no additional intervention was required. However, the patient is undergoing treatment for voiding dysfunction caused by a neurogenic bladder.
서론
희소돌기아교세포종(oligodendroglioma)은 원시 신경외배엽세포에서 기원하는 신경상피양 종양으로, 희소돌기아교세포로 구성되어 있는 악성 신경교종의 한 형태이다. 전체 원발 뇌종양의 4.2% 정도를 차지하며, 주로 청장년층 환자의 대뇌반구에서 특징적으로 발생한다[1,2]. 기형종(teratoma)은 소아에서 발견되는 가장 흔한 생식세포 종양으로, 천미부 기형종(sacrococcygeal teratoma)의 경우 신생아에서 가장 흔한 고형 종양 중 하나로 알려져 있다. 출생아 35,000–40,000명당 1명의 비율로 발생하며, 남아에 비해 여아에서 2–4배 정도 더 흔하다[3-5]. 기형종의 내부에서 다양한 종류의 양성 및 악성 병변이 동반되어 발생할 수 있는데 악성도는 진단 연령에 비례하며 대부분 영유아기에 진단되어 완전 절제 후 좋은 예후를 보인다[5]. 본 저자들은 미숙아에서 내부에 희소돌기아교세포종을 포함한 천미부 성숙 기형종으로 진단된 드문 임상 형태를 경험하여 이에 대한 치료 경험을 바탕으로 종양의 특성 및 치료 효과를 살펴보고자 한다.
증례
환아는 재태 연령 30주 0일, 출생체중 1,785 g (75–90백분위수), 1분/5분 Apgar 점수는 6점/8점으로 태어난 남아로, 조기 진통에 의해 질식분만으로 외부 병원에서 출생하였다. 환아의 어머니는 31세의 경산모로, 산전 초음파에서 태아의 항문 주위에 돌출된 낭종이 확인되어 정기적인 산전 진찰을 시행하던 중 재태주수 29주 0일 발생한 조기 진통으로 리토드린 및 아토시반과 함께 재태주수 29주 1일부터 2일간 베타메타손을 투약하며 경과 관찰하였으나 조절되지 않는 진통으로 출산하였다. 이 외 임신 중 기왕력 및 약물 복용력은 없었다. 출생 시 전신 청색증 및 흉부 함몰을 동반한 호흡 곤란으로 기관 삽관 후 인공 환기 보조요법 및 예방적 항생제를 투약을 시작하였고 생후 3일 기관 발관 후 지속기도양압 보조요법으로 변경하였다. 출생 당일부터 태변이 배출되고 신체 진찰 및 전신 방사선 사진에서 복부 상태가 양호하여 생후 2일에 경관영양으로 수유를 시작하고 중심정맥영양을 병행하였다. 항문 주위 낭종에 대해 생후 2일에 시행한 복부 초음파 및 생후 10일에 시행한 복부 전산화단층촬영 검사에서 골반 내강에 5.7×6.0 cm 크기의 다격벽 분화소엽 형태의 종괴가 확인되어 생후 13일(교정 연령 31주 5일, 체중 1,750 g)에 본원으로 전원 되었다. 골반 자기공명영상 검사를 진행하였으며 지방 성분과 뼈대 구조를 함유한 최장 11 cm 크기의 종괴가 천추골 전방부 에서 복강 내부까지 확장된 형태의 Type III 천미부 기형종으로 의심되었다(Figure 1). 흉부 전산화단층촬영 검사에서는 특이소견 없었고, 양전자 단층촬영에서도 복강과 골반강 외 병변은 없으며, 혈액검사에서 알파태아단백질(alpha-fetoprotein)은 64,537 ng/mL(reference mean value, 41,975 ng/mL), 베타 사람융모 생식샘자극호르몬(beta-human chorionic gonadotropin)은 0.54 mIU/ mL로 확인되었다. 생후 36일(교정 연령 35주 1일, 체중 2,980 g) 에 근치적 절제술을 시행하였는데, 복부 및 회음부 동시 접근을 통해 꼬리뼈 일부를 포함하여 완전 절제가 가능하였다. 절제한 종괴는 무게 104.4 g, 크기 12.0×8.1×2.5 cm로 측정되었고, 육안적으로 복강 내 종괴는 낭종성 병변의 형태를 보였지만 골반 내 종괴는 고형성 병변 형태를 보이는 낭성-고형성 혼합 종괴로 확인되었다. 종괴의 단면은 대체로 불균일하여 하얗고 단단한 부분, 연노란색의 반투 명한 부분, 그리고 노란색의 무른 부분으로 구성되어 있었다(Figure 2). 병리조직검사에서 성숙한 연골조직, 장 상피세포, 비각화 편평상피세포, 신경아교조직이 관찰되고 미성숙 조직은 관찰되지 않아 성숙형 기형종과 일치하는 조직학적 특징을 보였다(Figure 3A). 신경아교조직은 작고 둥근 핵 주변으로 핵주위무리(perinuclear halo)를 동반한 특징적인 소견(“fried egg” appearance)을 보이는 세포가 균일하게 증식한 병리조직검사 소견과 함께, 항-아교 세포섬유산성단백질 항체(anti-glial fibrillary acidic protein [GFAP] antibody)를 이용한 면역조직화학검사에서 양성 소견을 보여 희소돌기아교세포종(Central Nervous System World Health Organization [CNS WHO] Grade 2) [6]을 동반한 천미부 성숙 기형종으로 확인되었다(Figure 3B-D). 수술 20일 후 시행한 혈액검사 에서 알파태아단백질은 10,064 ng/mL (reference mean value, 16,000 ng/mL)로 감소하였으며, 수술 후 발생할 수 있는 수술 부위 감염, 배뇨 및 배변 장애, 하지 기능 장애와 같은 합병증 및 후유증은 보이지 않았다. 생후 13일(교정 연령 31주 5일, 체중 1,750 g)에 본원 전원 후 처음 시행한 갑상선 호르몬 기능 검사에서 갑상선 자극호르몬 8.39 μIU/mL, 유리 티록신 0.95 ng/dL로 확인되어 추적 검사중 생후 50일(교정 연령 37주 0일, 체중 3,150 g) 갑상선 자극호르몬 22.27 μIU/mL, 유리 티록신 0.95 ng/dL로 갑상선 기능 저하를 진단하고 레보티록신나트륨(10 μg/kg) 복용을 시작하였고, 생후 58일(교정 38주 1일, 체중 3,220 g)에 퇴원하였다. 천미부 성숙 기형종에 대해 보조 항암요법 등의 추가 치료는 없었고, 생후 10개월 및 25개월에 시행한 골반 자기공명영상 추적검사에서 종양의 재발 및 전이는 확인되지 않았으며, 생후 31개월 외래 추적 시 알파태아단백질이 3.75 ng/mL (reference mean value, 10 ng/mL)까지 감소한 소견을 보였다. 생후 25개월에 시행한 한국형 베일리 영유아 발달검사 제3판에서 영역별 종합점수가 인지영역 120점, 언어영역 106점, 운동영역 107점, 정서-사회성영역 90점, 적응 행동영역 109점으로 정상 발달이 확인되었다. 생후 31개월경 복압 배뇨(straining), 약뇨 (weak urine stream), 요주저(hesitancy), 배뇨 후 속옷 지림이 관찰되어 시행한 배뇨방광요도조영술에서는 역류가 관찰되지 않았으나, 요역동학검사에서 신경성 방광 의심되어 생후 33개월 현재 청결 간헐 도뇨(clean intermittent catheterization [CIC])를 하루 4회 시행 중이며, 대변 지림 등 배변 장애는 없는 상태이다. 갑상선 기능 저하증의 경우 약물복용 후 호르몬 수치가 안정적으로 조절되고 관련 증상이 없어 점차 레보티록신나트륨 체중당 복용 용량을 감량 중으로 생후 33개월 현재 갑상선 자극호르몬 2.03 μIU/mL, 유리 티록신 1.16 ng/dL으로 확인되어 레보티록신나트륨 3 μg/kg을 복용하며 경과 관찰 중이다.
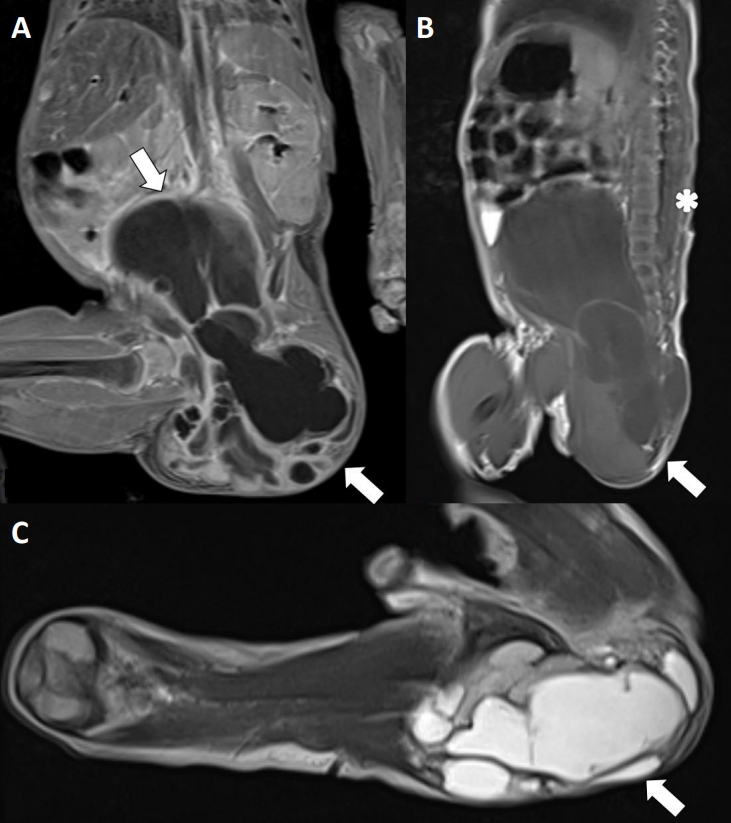
(A) Contrast-enhanced fat-saturated T1-weighted magnetic resonance image (MRI), coronal view (arrows), (B) T1-weighted MRI, sagittal view (arrow), and (C) double fat suppression of T2-weighted MRI, transverse view (arrow) reveals—a multicystic mass with a bony structure and fatty component. The longitudinal dimension of the cystic mass in the coronal image is 11 cm, which extends to the abdomen through the presacral space. The tip of the conus medullaris ends at approximately the L2 vertebra (asterisk).

Macroscopic examination shows (A) a mass measuring 12.0×8.1×2.5 cm in size. (B) The mass in the abdominal cavity (arrows) has characteristics of a cystic lesion, and the mass in the pelvis is identified as a mixed cystic-solid mass which is predominantly solid (open arrows).
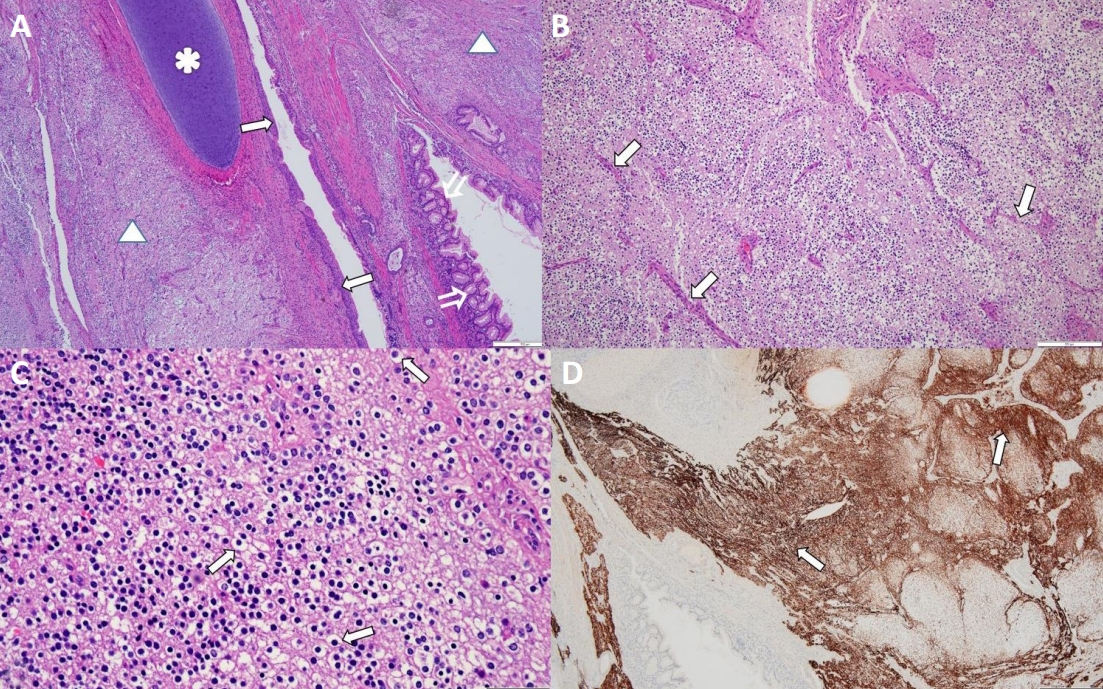
(A) The tumor shows mature cartilages (asterisk), colonic epithelium (open arrows), non-keratinizing squamous epithelium (arrows), and glial tissue (triangles) (hematoxylin and eosin [H&E], ×40). (B) Glial tissue shows uniform round nuclei with clear perinuclear halos, and delicate branching patterns of their vasculature exhibit a “chicken wire” arrangement (arrows) (H&E, ×100). (C) Glial tissue shows proliferation of monotonous cells with small and round nuclei with perinuclear clearing (fried egg appearance) (arrows) (H&E, ×400). (D) Glial tissue is positive for the anti-Glial fibrillary acidic protein antibody (immunoperoxidase staining, ×40) (arrows) (Scale bar, 500 μm).
고찰
기형종은 초기 배아 만능 줄기세포에서 유래하며, 3개의 배아층 (외배엽, 내배엽, 중배엽)에서 유리한 다양한 조직으로 구성되어 있다. 천추 또는 미추의 전방에 위치한 헨센 결절(Hensen’s nodule)은 만능 줄기세포가 집중된 곳으로 천미부 기형종은 영유아 고형 종양의 가장 흔한 종양으로 알려져 있다[4,5,7]. 출생아 35,000–40,000 명당 1명의 비율로 발생하며 여아 대 남아의 비는 2–4대 1로 여아에서 보다 많이 발견되는데, 여아에서 발생률이 높은 원인은 분명하지 않아 이와 관련하여 추가적인 연구가 필요할 것으로 판단된다[3-5]. 성숙 기형종과 미성숙 또는 악성 기형종으로 분류하고, 발생학적 특성상 양성 및 악성 병변이 동반될 수 있으며 낭종성 조직 및 고형 조직이 모두 관찰될 수 있다. 성숙 기형종의 경우 낭종성 조직이 많고 미성숙 또는 악성 기형종의 경우 고형 조직이 많은데, 영유아의 경우 양성 병변을 동반한 성숙 기형종이 가장 많다[4,7]. 악성화는 흔하지 않지만 진단 연령대가 증가할수록 악성도의 위험이 증가하여, 난소 기형종의 경우 성숙 낭종성 기형종의 1%–2% 정도에서 악성화가 진행되며 대부분 폐경 이후의 여성에서 확인되었다[5,8,9]. 세 배엽에서 유래된 모든 조직이 악성 변형을 겪을 수 있지만 상피 조직의 악성화가 가장 흔하여 편평세포암종(squamous cell carcinoma)이 80% 정도를 차지한다. 신경 조직에서 기원한 악성 종양이 발생하는 경우는 매우 드문데 신경모세포종(neuroblastoma), 교모세포종(glioblastoma), 중심신경세포종(central neurocytoma), 뇌실막종(ependymoma) 및 원시 신경외배엽종양(primitive neuroectodermal tumor)을 동반한 보고들이 있다[2,5,10,11].
본 증례는 재태 연령 30주 미숙아 남아의 천미골 부위에 발생한 성숙 기형종으로 신경상피성 기원의 희소돌기아교세포종을 동반한 극히 드문 경우이다. 현재까지 보고된 연구들을 살펴보았을 때 청소년 및 성인에서 발생한 난소 기형종에 동반된 희소돌기아교세포종인 경우가 대부분이었고[1,2,8-10,12,13], 드물게 성인의 자궁 경부에서 희소돌기아교세포종을 동반한 미성숙 기형종이 발생한 1례가 확인되었다[14]. 국내 연구진에 의해 희소돌기아교세포종을 동반한 천미부 미성숙 기형종이 보고된 예가 있으나 만삭으로 출생한 영아에서 진단된 경우였다(Table 1) [5]. 희소돌기아교세포종은 희소돌기아교세포(oligodendrocyte)로 구성되어 있는 신경상피양 종양(neurepithelial tumor)으로, 원시 신경외배엽에서 기원하며 주로 청장년층 환자의 대뇌 반구에서 발생한다[1,2]. 2021년도에 개정된 WHO 분류에 따라 CNS WHO Grade 2와 CNS WHO Grade 3으로 구분하는데, Grade 2는 가장 낮은 단계로 고분화 종양의 마지막 단계이며 Grade 3은 가장 높은 단계로 역형성 암종의 초기 단계로 볼 수 있다[1,6]. 본 증례의 경우 CNS WHO Grade 2로 확인되었다. 육안적으로 경계가 잘 지어져 있고 회색-분홍색을 띄며 부분적으로 낭종성 또는 석회화 변형을 동반한 고형 조직을 관찰할 수 있다. 병리조직검사에서는 작고 둥근 핵 주변으로 핵주위무리를 가진 구운 달걀을 연상시키는 균일한 세포로 구성된 소견을 확인할 수 있으며, 이와 함께 석회화와 연관된 모세혈관 문합이 섬세하게 연결되어 있는 소견(“chicken wire” appearance)도 확인할 수 있다. 다양한 뇌종양에서 희소돌기아교세포종과 유사한 세포가 관찰되어 감별 진단을 위해 면역조직화학검사를 시행하며, 희소돌기아교세포종의 경우 GFAP antibody를 이용한 면역조직화학검사에서 양성 소견을 보인다. 이와 비교해 중심신경세포종은 항-시냅토파이신 항체(anti-synaptophysin antibody)를 이용한 검사에서 양성 소견을 보인다[2,12].
기본적인 치료를 위해 완전한 외과적 절제가 필수적이며 병리조직학적 결과에 따라 부가적인 항암 치료나 방사선 치료가 필요한 경우가 있을 수 있다[8,9]. 뇌반구에 발생한 희소돌기아교세포종의 경우 수술 후 평균 4–8년 정도 생존을 보이는 것으로 알려져 있는데 결국 완전한 절제를 통해 장기간의 무병 기간을 얻을 수 있다[1]. 희소돌기 아교세포종이 동반된 기형종의 예후는 희소돌기아교세포종의 유무보다 기형종의 성숙도에 따라 달라져 성숙 기형종이 더 좋은 예후를 보이는 것으로 알려져 있으나[9,10], 현재까지 보고된 경우가 드문 관계로 장기간의 추적관찰을 통한 추가적인 연구가 필요하다. 종양 관련 알파태아단백질 혈청 수치는 정상보다 수백 또는 수천 배 상승할 수 있으며, 일반적으로 상승 정도가 높을수록 예후가 좋지 않다. 수술 후 알파태아단백질 수치가 상승하는 경우에는 종양을 완전히 절제하는데 실패했거나 항암치료에 실패했을 가능성, 또는 종양이 전이되었을 가능성을 고려해야 한다[4,5]. 또한 수술로 종양의 완전 절제가 이루어지고 종양이 재발하는 경우 없이 치료가 성공적일지라도 수술 후 동반될 수 있는 합병증이나 후유증에 의한 예후에도 관심을 기울여야 한다. 수술 부위 감염은 수술 후의 주된 합병증으로 항문과 수술 부위의 거리가 가까워 흔하게 발생할 수 있으며 피부 이식수술까지 필요한 경우가 있다. 이 외에도 배뇨 및 배변 장애, 하지 근력저하 또는 하지 마비와 같은 기능 장애와 생식능 저하 소견도 동반될 수 있다[3]. 본 증례 환아는 수술 후 배뇨 장애 증상이 동반되어 진행한 관련 평가에서 신경성 방광을 진단받고 CIC를 시행 중이다. 천미부 기형종의 경우 종양의 위치 및 크기에 의한 덩이 효과로 수술 전에 도장 폐색, 요관 폐색, 정맥 및 림프관 폐쇄와 연관된 증상을 보일 수 있다[15]. 환아의 경우 수술 전 기저귀를 착용한 상태로 천미부 기형종과 연관된 배뇨 및 배변 장애가 동반되었는지 정확한 평가가 어려우나 출생 당일부터 소변 및 태변 배출이 양호하였고 신체 진찰 및 영상검사에서 해당 소견이 확인되지 않았으며, 수술 후 배뇨 훈련을 시작하며 관련 증상이 확인되어 신경성 방광은 수술 후 합병증으로 판단된다. 이와 같은 술 후 합병증 및 후유증은 장기적으로 보았을 때 환자의 삶의 질과도 밀접한 연관이 있는 문제로, 정기적이고 지속적인 추적 평가를 통해 적절한 시기에 치료가 이루어질 수 있도록 관련 의료진의 체계적이고 다학제적인 관리가 필요하겠다.
이 외에도 환아는 수술 후 갑상선 기능 저하증을 진단받고 현재까지 약물복용을 유지하며 추적관찰 중에 있다. 수술 이후에도 갑상선 자극 호르몬 상승 및 유리 티록신 저하가 지속되어 천미부 기형종과 갑상선 기능 저하증이 연관되었을 가능성은 적을 것으로 추정되나, 본 증례와 같이 수술 전 또는 수술 후 갑상선 기능 이상이 동반된 천미부 기형종은 현재까지의 보고에서 확인되지 않고, 현재 보고된 증례에서도 갑상선 기능 관련 검사에 대한 내용이 없어 추후 기형종으로 진단된 환아에서 갑상선 기능에 대한 추가적인 증례 보고나 연구가 필요할 것으로 생각된다.
본 증례는 신생아에서 발생한 매우 드문 형태의 종양 질환에 대한 외과적 절제의 의미 있는 치료 효과를 확인한 경우로, 환아는 완전한 외과적 절제 후 추가적인 처치 없이 재발하지 않는 상태로 생존 중이며, 신경성방광에 의한 배뇨 장애를 치료하고 있다.
Notes
Ethical statement
This study was approved by the Institutional Review Board of the present institution (IRB No. 05-2022-096). Written informed consent was obtained from all parents.
Conflicts of interest
No potential conflict of interest relevant to this article was reported.
Author contributions
Conception or design: M.H.J., Y.H.C., N.L.
Acquisition, analysis, or interpretation of data: M.H.J., S.H.J., C.S.H., Y.H.C., S.Y.B., N.R.L.
Drafting the work or revising: M.H.J., N.L.
Final approval of the manuscript: All authors read and approved the final manuscript.
Funding
This study was supported by 2022 research grant from Pusan National University Yangsan Hospital.
Acknowledgements
None

