 |
 |
- Search
| Neonatal Med > Volume 29(3); 2022 > Article |
|
Abstract
ARTICLE INFORMATION
Ethical statement
This study was approved by the Institutional Review Board of Seoul National University Hospital (IRB No.: 2205-058-1322, approval date: June 20, 2022). Written informed consent by the patients was waived due to the retrospective nature of our study.
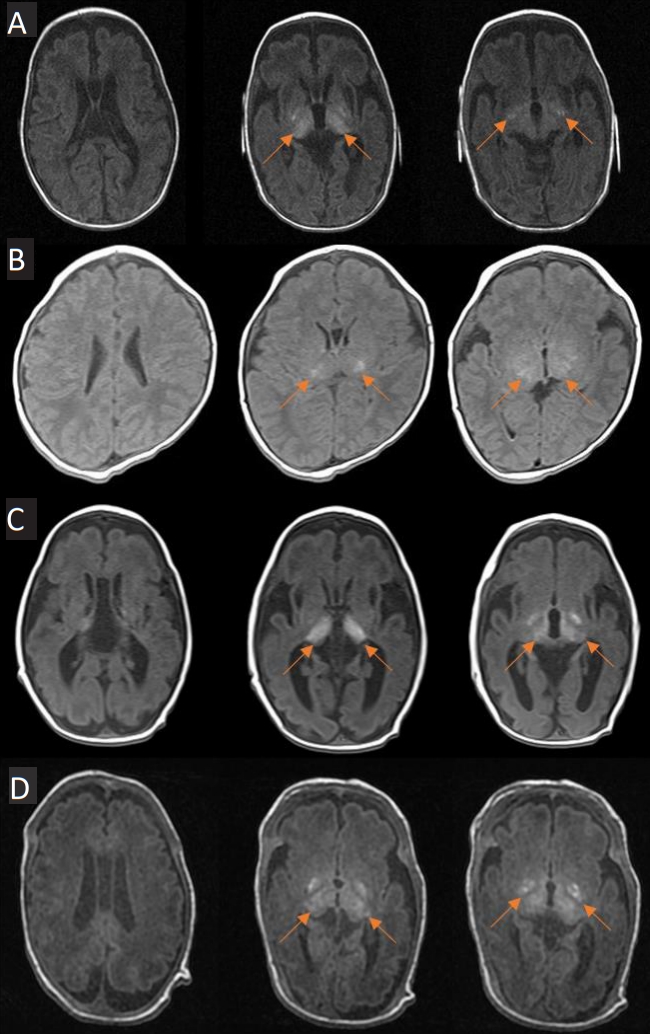
Figure┬Ā1.
Table┬Ā1.
| GA (wk) | Birth weight (g) | Sex | Outborn | Multiple birth | Seizure | Hypotonia | Perinatal problem | FHRP | Mode of delivery | Apgar score | Resuscitation at delivery room | Cord BGA (pH/BE) | Diagnosis during NICU care | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A | 32+3 | 1,250 | M | Yes | No | + | NA | Placental abruption | Normal | EmCS | 0-3-6 | Intubation (+) | NA | HIE, ROP stage 3, 2ŌĆÖASD, mild BPD |
| CM (+) | ||||||||||||||
| B | 29+3 | 1,510 | M | Yes | No | + | + | PTL | Deceleration | EmCS | 0-1-4 | Intubation (+) | NA | HIE, recurrent aspiration pneumonia, CRE sepsis, TPN-induced cholestasis, ROP stage 2 |
| CM (+) | ||||||||||||||
| C | 31+0 | 1,690 | M | No | Yes* | + | + | Cord entanglement | Deceleration | EmCS | 3-7 | Intubation (+) | 7.33/ŌĆō3.3 | HIE, AKI, ROP stage 1, GMH |
| CM (ŌĆō) | ||||||||||||||
| D | 29+0 | 1.36 | M | Yes | No | + | + | GDM, pneumonia due to COVID-19 infection | Deceleration due to maternal cardiac arrest | EmCS | 3-4 | Intubation(+) | 7.316/ŌĆō0.5 | HIE, recurrent aspiration pneumonia, ROP stage 3, TPN induced cholestasis |
| CM (+) |
ROP stage: 1-demarcation line, 2-ridge, 3-ridge with extra retinal fibrovascular proliferation, 4-subtotal retinal detachment, 5-total retinal detachment.
Abbreviations: GA, gestational age; FHRP, fetal heart rate pattern; BGA, blood gas analysis; BE, base excess; NICU, neonatal intensive care unit; NA, not available; EmCS, emergency Cesarean section; CM, cardiac massage; HIE, hypoxic ischemic-encephalopathy; ROP, retinopathy of prematurity; ASD, atrial septal defect; BPD, bronchopulmonary dysplasia; PTL, preterm labor; CRE, carbapenem-resistant Enterobacteriaceae; TPN, total parenteral nutrition; AKI, acute kidney injury; GMH, germinal matrix hemorrhage; GDM gestational diabetes; COVID-19, coronavirus disease 2019.
Table┬Ā2.
Abbreviations: MRI, magnetic resonance imaging; PMA, post menstrual age; NICHD-NRN, National Institute of Child Health and Human Development Neonatal Research Network; IVH, intraventricular hemorrhage; OPD, out-patient department; FU, follow-up; T1WI, T1-weighted image; BG, basal ganglia; SI, signal intensity; GMFCS, Gross Motor Function Classification System; CP, cerebral palsy; K-DST, Korean Developmental Screening Test for Infants & Children; PEG, percutaneous endoscopic gastrostomy; CA, corrected age.
REFERENCES
-
METRICS

-
- 1 Crossref
- 2,231 View
- 50 Download
- Related articles in NM
-
The Use of Probiotics in Preterm Infants2022 May;29(2)
Management of Persistent Pulmonary Hypertension in Preterm Infants2021 February;28(1)
Clinical Features of Late-Onset Circulatory Collapse in Preterm Infants2019 August;26(3)
Early Detection of White Matter Lesion in Premature Infants1994 November;1(2)






